应用纳米材料的医疗器械安全性和有效性评价指导原则 第二部分:理化表征(2023年第15号)
发布日期:2023-04-28 阅读量:次
附件:应用纳米材料的医疗器械安全性和有效性评价指导原则 第二部分:理化表征(2023年第15号).doc
应用纳米材料的医疗器械安全性和有效性
评价指导原则第二部分:理化表征
本指导原则为注册申请人/监管人员提供关于应用纳米材料的医疗器械理化表征相关方面的信息。
本指导原则是对应用纳米材料医疗器械理化表征的一般要求,注册申请人应依据具体产品的特性对注册申报资料的内容进行充分说明和细化。注册申请人还应依据具体产品的特性确定其中的相关内容是否适用,若不适用,需详细阐述理由及相应的科学依据。
本指导原则是对注册申请人和审评人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能满足相关法规要求的其它方法,也可以采用,但是需要提供详细的研究资料和验证资料。应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将进行适时的调整。
一、适用范围
本指导原则适用于与人体直接或间接接触,由纳米材料组成或包含纳米材料的医疗器械的理化表征。
不适用于:
- 应用纳米材料的体外诊断产品;
- 应用纳米材料的药品;
- 纳米技术赋能的医疗产品(如纳米机器人);
- 应用纳米材料的医疗器械在制造和废弃过程中造成的职业和环境风险。
二、理化表征在应用纳米材料的医疗器械申报资料中的体现
应用纳米材料的医疗器械产品的安全性和有效性与所使用的纳米材料的理化性质(如化学组成、尺寸及尺寸分布、形态学、表面特性等)紧密相关。根据国家药品监督管理局发布的《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》,理化表征在应用纳米材料的医疗器械产品安全性和有效性评价的意义和作用主要体现在以下申报资料中:
(一)监管信息(委托信息、主文档授权信)
应用纳米材料的医疗器械产品注册申请人可自行独立研发、或委托第三方研发纳米原材料,或直接外购纳米原材料。注册申请人应具备对于纳米原材料的完整评价和供应商审核能力,并证明其对医疗器械终产品生产关键工艺及参数进行质量控制的能力。因此,如果医疗器械的原材料为纳米材料,注册申请人应提供包括纳米原材料的理化表征在内的质量控制文件。如果委托其他企业生产的,应当提供受托企业资格文件、委托合同和质量协议。在质量协议中,应提供纳米材料质量控制相关参数。如果原材料供应商已在国家药品监督管理局医疗器械技术审评中心进行过主文档备案,应提交主文档授权信。
(二)研究资料(产品化学和物理性能研究)
注册申请人在设计应用纳米材料的医疗器械时,预期利用纳米材料的某些特殊性能,如小尺寸、高比表面积、高化学活性,或者利用纳米表面特性对于体内微环境的影响来发挥其功能。如纳米银敷料利用了纳米银在一定时期内可持续释放银的特性。又如某些骨科植入物表面纳米结构的设计,可以促进骨重建过程。为证明产品中所设计应用的纳米材料能够发挥预期特性,注册申请人需开展有针对性的理化性质表征。这些研究也将成为确定产品技术要求中科学合理的性能指标和检验方法的关键依据。
(三)研究资料(产品生物学特性研究)
现行的GB/T 16886.1(ISO 10993.1)将理化表征作为医疗器械生物相容性评价的起点。对于应用纳米材料的医疗器械,这一点尤为重要,因纳米材料的生物学效应取决于其理化性质,如尺寸及尺寸分布、形态学、表面特性、化学组成、团聚/聚集状态等。在生物相容性/毒理学研究过程中,注册申请人不仅要对医疗器械产品中的纳米材料开展理化表征,而且根据风险分析,确定是否需要针对在生物组织/体液中的纳米材料及其代谢/转归产物开展理化表征。客观、真实的定性/定量理化表征结果,可为开展生物相容性/毒理学研究提供必要的信息。相反,非客观、真实的定性/定量理化表征结果,可能导致对于产品安全性风险的错误判定。
(四)研究资料(清洁、消毒、灭菌研究)
在应用纳米材料的医疗器械生产工艺过程中,作为原材料之一的纳米材料通常经过多道工艺过程,生产工艺过程对于终产品中纳米材料存在状态的影响,以及产品的批间/批内稳定性和均一性需要通过充分的理化表征来证明。
建议注册申请人在灭菌方法验证中对于纳米材料特性加以考虑,如:辐照剂量对于纳米材料是否存在影响,环氧乙烷是否会残留在纳米材料结构中难以解析等。此外,注册申请人在考虑对于验证所需产品批次和样本量的要求时,也需要通过理化表征对于纳米材料在医疗器械中分布的均匀性等因素进行研究分析。
(五)研究资料(稳定性研究)
理化表征同样对于产品货架有效期和包装验证非常重要。目前,产品有效期验证所采用的加速老化计算依据仍是根据传统高分子材料总结的阿累尼乌斯(Arrhenius)反应公式,该公式是否适用于纳米材料仍有待深入研究。因此,建议注册申请人在有效期各时间点应针对纳米材料开展适宜的理化表征,以证明医疗器械中的纳米材料是否在储存期内发生物理性质和化学性质的变化。
(六)产品临床评价资料
目前,应用纳米材料的医疗器械临床评价尚缺乏相应的指导原则/审评要点。注册申请人应根据申报产品的适用范围、技术特征、已有临床数据等具体情况,选择恰当的临床评价路径,包括“同品种临床评价路径”和/或“临床试验路径”。若注册申请人通过同品种临床评价路径进行临床评价,除了提交申报产品与同品种医疗器械在适用范围、技术特征、生物学特性方面的对比资料,注册申请人还需开展具有针对性和特异性的完整而全面的理化表征研究,这对于确定对照产品是否为同品种产品是至关重要的。
三、纳米材料理化性质表征的基本原则
纳米材料尺寸小、比表面积大、化学活性高,在不同环境中表面特性和聚集状态易发生变化,这给纳米材料的生物学效应评估带来挑战。针对应用纳米材料的医疗器械开展全面而准确的理化性质表征以及使用过程中纳米材料理化性质变化测量都至关重要。应用纳米材料的医疗器械的理化表征流程图可以参考图1a。根据产品及纳米材料的性质,可以选择不同阶段的理化检测项目,流程图1b中给出了检测项目示例。该理化表征可分为三个层次:纳米原材料、医疗器械终产品中的纳米材料、生物组织样本中的纳米材料(仅适用于生物组织吸收了应用纳米材料的医疗器械释放的纳米材料;或者应用纳米材料的医疗器械中的纳米材料释放并迁移到了生物组织样本中)。

开展应用纳米材料医疗器械理化表征的第一步是对作为医疗器械生产的起始纳米原材料和终产品中的纳米材料进行理化表征,包括形态学、尺寸、团聚/聚集状态、晶体结构、比表面积、化学组成与纯度、表面特性等。通过同时表征的数据证明起始原料的表征数据与终产品中应用的纳米材料是否相同。如果相同或者有数据阐明相似的材料具有足够相似的理化性质,可以考虑采用这些数据来进行产品的风险评估。如果不同,则应以终产品的详细表征数据为基础进行风险评估。为了确保在同一工艺参数下,产品的质量差异在可接受的偏差范围内,注册申请人需对产品中的纳米材料进行明确的稳定性和均一性评价。评价内容包括储存、运输、使用等过程中,纳米材料受环境等因素影响,随时间推移造成的几何形态学、尺寸、聚集状态、化学成分、氧化状态等理化性质的变化。
需要强调的是,纳米材料可能在加工过程中改变其表面化学,比如获得新的或额外的表面分子,作用类似于涂层;或者氧化状态改变等。鉴于这些潜在的表面改变,如有必要,注册申请人应考虑纳米材料在测试和/或使用的不同阶段开展理化性质表征。
对于与人体有直接或间接接触的医疗器械,纳米材料的脱落和释放风险是必须要考虑的。游离的纳米材料或释放的离子进入体内是可能引起在个体水平、组织水平以及细胞和分子水平上不良反应的关键因素。因此需要根据纳米材料脱落/释放的风险评估,对可能暴露的纳米材料进行分析与理化表征,包括测量释放元素的种类与释放元素总量,以及测量释放液中可能存在的纳米颗粒以及离子浓度。需要指出的是:纳米材料的脱落和释放评价不仅限于体外评价,如适用,鼓励注册申请人同时开展体外和体内纳米材料脱落和释放评价研究,并将体外和体内研究结果相关联。
产品使用过程中脱落或释放的纳米材料,以及由纳米材料释放的离子可随血液系统或淋巴系统进入体内循环,并在组织器官中蓄积。纳米材料在生物组织中的蓄积量、存在形式(颗粒或其降解产物)以及材料结构是否出现缺陷决定了其在体内的稳定性和潜在的生物安全性。因而如果从产品中脱落/释放的纳米材料有进入体内循环系统的风险,则有必要提供生物组织中纳米材料的蓄积量数据,并证实其存在形式、结构等理化性质。
如本指导原则第二部分所述,在原材料质控、产品有效性研究、产品安全性研究、产品生产工艺和质量控制研究,以及产品临床评价中,需要针对不同样本中的纳米材料进行适宜的理化表征。注册申请人、科研人员、检测人员,以及审评人员应当认识到,只有采用适合产品特点,并能最大限度保持或模拟产品与人体接触暴露环境的理化表征手段,且试验人员和评价人员具备足够的纳米材料相关知识的前提下,理化表征结果才能用于正确评价应用纳米材料的医疗器械安全性和有效性。
例如,在开展纳米银敷料类产品理化表征时,应在总银含量和可溶性银含量的测定研究中,正确区分离子形式的银和纳米颗粒状态的银,同时需要区分银的价态。目前,测定总银含量的主流方法是经硝酸消解后采用ICP-MS方法分析。注册申请人应考虑将经验证的单颗粒ICP-MS、同步辐射方法、光电子能谱(XPS)、高光谱成像方法等,用于实际纳米银敷料产品的研究,以便区分释放的银是离子状态还是颗粒状态,以及银的价态,同时借助原位、无损、高灵敏度的分析方法来明确生物转运过程中银的化学性质转化,探讨生物体银的化学性质信息与生物效应的关系。
前期研究工作已证实纳米材料有可能与蛋白质相互作用,形成蛋白冠,影响纳米颗粒的各种生物学效应。在银的释放试验中,如果仅采用简单体外模型,例如采用不含蛋白的纯水、PBS或生理盐水研究银的释放/溶出,则无法反映临床使用中实际创面及其渗出液存在蛋白或其他成分的复杂情况,特别是形成蛋白冠现象,应考虑这一因素对于产品中银的释放/溶出,以及进入体内的行为和生物学效应的影响。
应用纳米材料的医疗器械理化表征和测量方法示例见附件1的表1,该表内容主要来源于GB/T 39261(ISO/TR 13014),以及ISO/TR 10993.22。注册申请人应根据产品及纳米材料特性选择适合的理化表征方法组合。此外,如有必要,注册申请人也应提供该表之外检测方法获得的额外信息以便进行风险评估。需要指出的是,当前大多数纳米材料理化表征方法是针对科研或工业中应用的纳米材料制订的,并未采用实际医疗器械产品进行过纳米材料表征或者生物样本中纳米材料表征的验证和优化。因此,注册申请人在采用相关标准方法开展理化表征研究时,需对所采用的方法是否适用于应用纳米材料的医疗器械进行验证,充分考虑所采用的方法中不适用部分的改进和优化。
四、现行可用标准简介
目前,针对纳米材料或纳米技术的国内标准(包括国家标准、行业标准、地方标准、团体标准)有近200个。其中涉及理化表征的技术方法类或指南类标准约有100个,均可选择性地被用于应用纳米材料的医疗器械理化表征检测。另外,还有很多并非针对纳米材料或纳米技术的方法标准也可用于应用纳米材料的医疗器械理化表征检测。附件1的表1中尽可能收集了纳米材料理化表征相关的标准。但注册申请人、检测机构,以及审评部门应根据应用纳米材料的医疗器械预期用途、结构组成、作用机理、与人体的暴露途径/时间、纳米材料在医疗器械中的存在形式等因素,综合考虑上述标准是否适用于医疗器械中的纳米材料表征。
目前,国家药监局已发布了三项专门针对应用纳米材料的医疗器械行业标准,分别是YY/T 1295《医疗器械生物学评价 纳米材料:细菌内毒素试验》、YY/T 0993《医疗器械生物学评价 纳米材料:体外细胞毒性试验(MTT试验和LDH试验)》,以及YY/T 1532《医疗器械生物学评价 纳米材料 溶血试验》,其中都涉及到对于纳米材料理化表征的相关要求。YY/T 1863《纳米医疗器械生物学评价 含纳米银敷料中银颗粒和银离子的释放与表征方法》行业标准即将发布,该标准给出了具体的释放试验方法与表征方法。
此外,已发布的GB/T 38261《纳米技术 生物样品中银含量测量 电感耦合等离子体质谱法》标准适用于各种生物组织中银含量的定量测量。
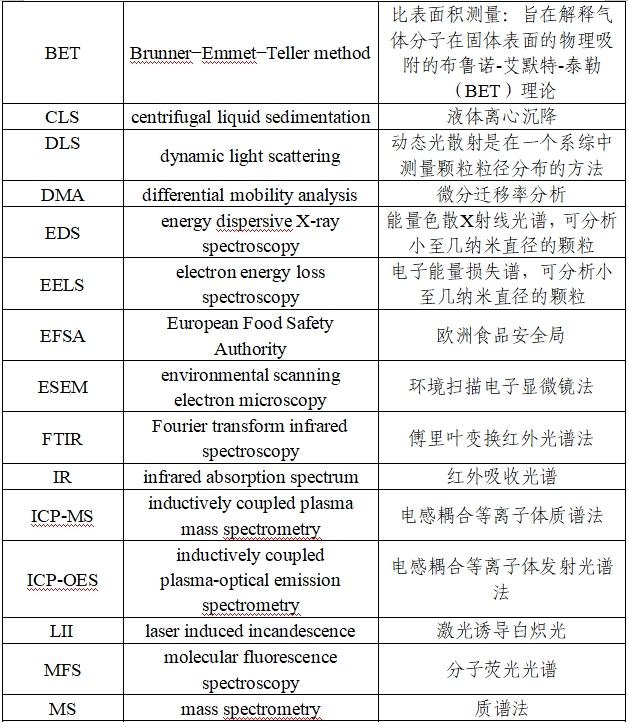
五、缩略语和术语表



六、参考文献
[1]GB/Z 16886.22-2022(ISO/TR 10993.22:2017,IDT),医疗器械生物学评价-第22部分:纳米材料指南[S].
[2]GB/T 39261-2020,纳米技术 纳米材料毒理学评价前理化性质表征指南[S].
[3]国家药品监督管理局.医疗器械注册申报资料要求和批准证明文件格式:国家局公告2021年第121号[Z].
[4]GB/T 38261-2019,纳米技术 生物样品中银含量测量 电感耦合等离子体质谱法[S].
[5]ISO/TR 13014:2012,纳米技术——工程纳米材料理化特性毒理学评估指南Nanotechnologies-Guidance on physico-chemical characterization of engineered nanoscale materials for toxicologic assessment[S].
[6]GB/T 21649.1-2008,粒度分析 图像分析法 第1部分:静态图像分析法[S].
[7]GB/T 15445.6-2014,粒度分析 结果的表述 第6部分:颗粒形状和形态的定性及定量表述[S].
[8]GB/T 27788-2020,微束分析 扫描电镜 图像放大倍率校准导则[S].
[9]ISO 21363:2020, Nanotechnologies - Measurements of particle size and shape distributions by transmission electron microscopy[S].
[10]ISO 19749:2021, Nanotechnologies - Measurements of particle size and shape distributions by scanning electron microscopy[S].
[11]JY/T 0582-2020,扫描探针显微镜分析方法通则[S].
[12]ISO/TS 19590:2019, Nanotechnologies - Size distribution and concentration of inorganic nanoparticles in aqueous media via single particle inductively coupled plasma mass spectrometry[S].
[13]GB/T 29022-2021,粒度分析 动态光散射法(DLS)[S].
[14]GB/T 19627-2005,粒度分析 光子相关光谱法[S].
[15]GB/T 20307-2006,纳米级长度的扫描电镜测量方法通则[S].
[16]GB/T 30543-2014,纳米技术 单壁碳纳米管的透射电子显微术表征方法[S].
[17]ISO 19430:2016, Particle size analysis Particle tracking analysis (PTA) method[S].
[18]ISO 13318, Determination of particle size distribution by centrifugal liquid sedimentation methods系列标准[S].
[19]GB/T 19077-2016,粒度分析 激光衍射法[S].
[20]GB/T 32871-2016,单壁碳纳米管表征 拉曼光谱法[S].
[21]GB/T 29024,粒度分析 单颗粒的光学测量方法 系列标准[S].
[22]GB/T 41316-2022,分散体系稳定性表征指导原则[S].
[23]GB/T 38431-2019,颗粒分散体系稳定性评价 静态多重光散射法[S].
[24]GB/T 19587-2017,气体吸附BET法测定固态物质比表面积[S].
[25]GB/T 39713-2020,精细陶瓷粉体比表面积试验方法 气体吸附BET法[S].
[26]GB/T 21650,压汞法和气体吸附法测定固体材料孔径分布和孔隙度 系列标准[S].
[27]GB/T 17359-2012,微束分析 能谱法定量分析[S].
[28]GB/T 30703-2014,微束分析 电子背散射衍射取向分析方法导则[S].
[29]GB/T 28634-2012,微束分析 电子探针显微分析 块状试样波谱法定量点分析[S].
[30]GB/T 25189-2010,微束分析 扫描电镜能谱仪定量分析参数的测定方法[S].
[31]GB/T 30543-2014,纳米技术 单壁碳纳米管的透射电子显微术表征方法[S].
[32]GB/T 36065-2018,纳米技术 碳纳米管无定形碳、灰分和挥发物的分析 热重法[S].
[33]GB/T 30903-2014,无机化工产品 杂质元素的测定 电感耦合等离子体质谱法(ICP-MS)[S].
[34]GB/T 38261-2019,纳米技术 生物样品中银含量测量[S].
[35]GB/T 38789-2020,口腔清洁护理用品 牙膏中10种元素含量的测定 电感耦合等离子体质谱法[S].
[36]GB/T 25185-2010,表面化学分析 X射线光电子能谱 荷电控制和荷电校正方法的报告[S].
[37]GB/T 26533-2011,俄歇电子能谱分析方法通则[S].
[38]GB/T 29558-2013,表面化学分析 俄歇电子能谱 强度标的重复性和一致性[S].
[39]GB/T 29556-2013,表面化学分析 俄歇电子能谱和X射线光电子能谱 横向分辨率、分析面积和分析器所能检测到的样品面积的测定[S].
[40]GB/T 30702-2014,表面化学分析 俄歇电子能谱和X射线光电子能谱 实验测定的相对灵敏度因子在均匀材料定量分析中的使用指南[S].
[41]GB/T 28893-2012,表面化学分析 俄歇电子能谱和X射线光电子能谱 测定峰强度的方法和报告结果所需的信息[S].
[42]GB/Z 32494-2016,表面化学分析 俄歇电子能谱 化学信息的解析[S].
[43]GB/T 24581-2022,硅单晶中III、V族杂质含量的测定 低温傅立叶变换红外光谱法[S].
[44]GB/T 39114-2020,纳米技术 单壁碳纳米管的紫外/可见/近红外吸收光谱表征方法[S].
[45]JY/T 022-1996,紫外和可见吸收光谱方法通则[S].
[46]GB/T 19502-2004,表面化学分析 辉光放电发射光谱方法通则[S].
[47]GB/T 30902-2014,无机化工产品 杂质元素的测定 电感耦合等离子体发射光谱法(ICP-OES)[S].
[48]GB/T 33324-2016,胶乳制品中重金属含量的测定 电感耦合等离子体原子发射光谱法[S].
[49]GB/T 30905-2014,无机化工产品 元素含量的测定 X射线荧光光谱法[S].
[50]JY/T 0573-2020,激光拉曼光谱分析方法通则[S].
[51]GB/T 29858-2013,分子光谱多元校正定量分析通则[S].
[52]JY/T 0578-2020,超导脉冲傅里叶变换核磁共振波谱测试方法通则[S].
[53]DB46/T 520-2020,全生物降解塑料制品 核磁共振波谱快速检测法[S].
[54]GB/T 33523-2017,产品几何技术规范(GPS) 表面结构 区域法 系列标准[S].
[55]GB/T 33498-2017,表面化学分析 纳米结构材料表征[S].
[56]GB/T 28894-2012,表面化学分析 分析前样品的处理[S].
[57]GB/T 40109-2021,表面化学分析 二次离子质谱 硅中硼深度剖析方法[S].
[58]GB/T 25186-2010,表面化学分析 二次离子质谱 - 由离子注入参考物质确定相对灵敏度因子[S].
[59]GB/T 32671,胶体体系 zeta电位测量方法 系列标准[S].
[60]GB/T 41316-2022,分散体系稳定性表征指导原则[S].
[61]GB/T 38431-2019,颗粒 分散体系稳定性评价 静态多重光散射法[S].
[62]欧盟新兴与新识别健康风险委员会(SCENIHR),医疗器械中应用的纳米材料潜在健康效应指导原则 Guidance on the Determination of Potential Health Effects of Nanomaterials Used in Medical Devices,Scientific Committee on Emerging and Newly Identified Health Risks[Z]. 2015
[63]THE U.S. FOOD AND DRUG ADMINISTRATION. Nanotechnology—Over a Decade of Progress and Innovation, 2020[R].
[64]G.A.Martínez-Castaón, F.Martínez-Gutiérrez, F.Ruiz, et al. Characterization and biocompatibility of chitosan gels with silver and gold nanoparticles[J]. J Nanomater, 2014, 543419.
[65]Harada Masafumi, Yamamoto Miho, Iwase Hiroki. Combined small-angle neutron scattering/small-angle X‑ray scattering analysis for the characterization of silver nanoparticles prepared via photoreduction in water-in-oil microemulsions[J]. Langmuir 2021, 37:13085−13098.
[66]J Liu,KE Murphy,RI Maccuspie, et al. Capabilities of single particle inductively coupled plasma mass spectrometry for the size measurement of nanoparticles: a case study on gold nanoparticles[J]. Anal. Chem. 2014, 86:3405–3414.
[67]DE Gorka, NJ Lin, JM Pettibone, et al. Chemical and physical transformations of silver nanomaterial containing textiles after modeled human exposure[J]. NanoImpact. 2019, 14C:100160.
[68]Wang Liming, Zhang Tianlu Li Panyun, et al. Use of Synchrotron Radiation-Analytical Techniques To Reveal Chemical Origin of Silver-Nanoparticle Cytotoxicity[J]. ACS Nano 2015, 9:6532-6547.
[69]YY/T 1295-2015,医疗器械生物学评价 纳米材料:细菌内毒素试验[S].
[70]YY/T 0993-2015,医疗器械生物学评价 纳米材料:体外细胞毒性试验(MTT试验和LDH试验)[S].
[71]YY/T 1532-2017,医疗器械生物学评价 纳米材料 溶血试验[S].
[72]YY/T 1863-2023,纳米医疗器械生物学评价 含纳米银敷料中银颗粒和银离子的释放与表征方法[S].
七、编写单位
本指导原则由国家药品监督管理局医疗器械技术审评中心牵头,国家纳米科学中心、中国食品药品检定研究院参与编写,由国家药品监督管理局医疗器械技术审评中心负责解释。
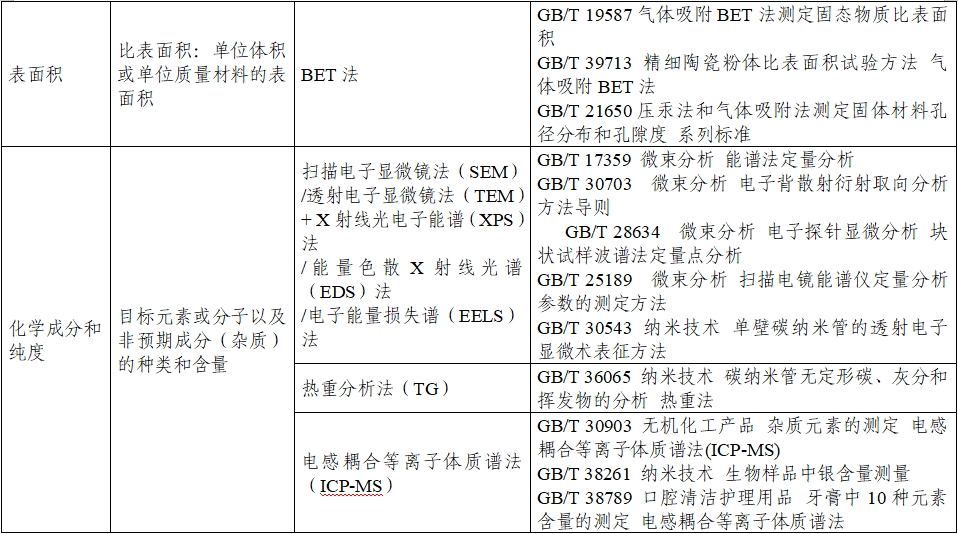
附件1
医疗器械中应用的纳米材料理化表征方法及相关标准







附件2
常用纳米材料理化表征方法简介及表征实例
各种表征方法的测试原理不同,因而不同方法具有其局限性。例如,没有一种单一方法可以实现所有纳米材料全尺寸范围的粒度测量,而且不同方法对同一样品测量也会给出不同的粒径分布。这就是EFSA和SCCS都在其指南中要求至少两种尺寸测量方法、其中一种应是电子显微镜方法的原因之一。遵循这一原则,医疗器械中应用的纳米材料表征也要符合同样的要求。对于块体形式的材料(物质),已经有国际接受的鉴别和测量标准,其中一些方法可用于(或经调整后用于)纳米材料检测和表征。需要指出的是,下面的常用表征方法并非穷举。纳米材料/纳米技术在医疗器械中的应用是一个新兴的领域。注册申请人、科研机构、检测机构等可根据医疗器械中应用的纳米材料特点,制定更为适合的表征方法。但应提交完整的方法学研究/验证资料。
1.电子显微技术
电子显微技术是最为常见的可用方法之一。扫描电子显微镜法(SEM)和透射电子显微镜法(TEM)是两种典型的电子显微成像技术方法,这两种显微技术方法都使用电子或电子束获得高空间分辨图像。在分辨率方面,TEM一般能达到0.1 nm,能够在实现纳米材料的高分辨形态学成像的同时实现对其晶格、晶相的分析,而SEM的分辨率只能到~1 nm。然而,TEM成像要求样品厚度非常薄(通常小于100 nm),对于固态医疗器械样品需要经渗透、包埋等处理后,进行切片制样。而SEM无需特殊制样,且图像具有更好的场深,但是成像会受表面荷电效应影响。SEM和TEM示例见图1和图2。

扫描透射电子显微镜法(STEM)为透射电子显微镜法提供了新的成像方式。在STEM中,一束精准聚焦的电子束通过光栅扫描在样品上,然后收集成像信号(包括透射束的强度、二次电子发射,以及弹性散射电子等)。STEM的典型空间分辨率优于1 nm,在高分辨系统中可能达到约0.1 nm。在SEM和STEM成像中,可对不同点进行EDS或者EELS扫描获得化学组成信息。因此,通过不同分析方法的组合,可获得尺寸、形状、结构、组成以及表面特性等重要信息。SEM-EDS示例见图3。

常规的电子显微技术仅适用于低挥发性的牢固颗粒,而环境电子扫描电子显微镜法(ESEM)克服了一些分析环境限制,该方法允许带有一定挥发性成分的样品进行表征。ESEM示例见图4。

2.扫描探针显微镜法(SPM)
SPM利用探针在表面扫描实现成像。最初SPM的发展利用了位于导电样品和悬在其表面上方几个埃的探针之间的电子隧道电流,这可以埃的分辨率绘制形态学特征(即扫描隧道显微镜法STM)。利用不同的高度反馈机制发展了多种不同原理的SPM,包括原子力显微镜法(AFM)、磁场力显微镜法(MFM)、侧向力显微镜法、剪切力显微镜法等。所有方法可在一系列环境中使用,包括大气条件、液体沉浸和真空。
AFM测量既可以在探针接触样品的状态下运行(接触式AFM),也可以在探针悬空状态下进行(间距数个纳米或更大,即非接触式AFM)。AFM可以表征形态学、尺寸、摩擦力特性以及其他力。相比于SEM,AFM有几个优点:(1)能提供三维表面形态学;(2)样品不需要任何特殊处理(例如金属/碳包被);(3)成像不受到电荷伪影的影响;(4)可在空气、液体环境中工作。
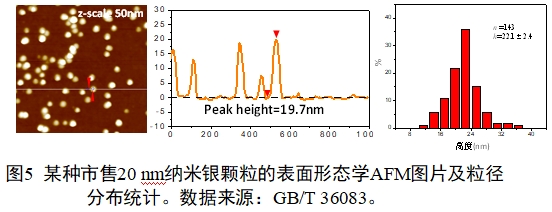
AFM也具有其劣势,如:(1)成像高度范围一般为10-20 μm;(2)最大扫描面积约为10 μm×10 μm;(3)针尖磨损情况成像容易出现重影。AFM示例见图5。
3.小角X射线散射(SAXS) 法
SAXS和超小角X射线散射 (USAXS) 法属于用来表征材料的X射线散射技术类别。SAXS是一项小角散射(SAS)技术,物质纳米尺度内的电子密度差异产生的非常小角度范围(典型为0.1-10°)的X射线弹性散射。这一角度范围包含关于大分子形状和尺寸、部分有序材料的特征距离、孔径,以及其他数据的信息。SAXS可以传递介于5到25 nm之间的大分子结构信息。USAXS可以处理更大的尺度。SAXS示例见图6。

4.光散射法
动态光散射(DLS)法和颗粒跟踪分析(PTA)法都测量纳米颗粒的布朗运动,其运动速度或扩散系数通过斯托克斯-爱因斯坦方程与粒径相关联。
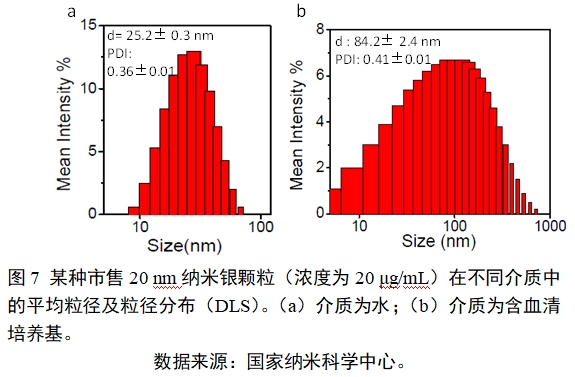
DLS测量基于入射光通过溶液中的颗粒时发生散射,散射光产生多普勒位移,由于颗粒的布朗运动,通过测定散射光频率与入射光频率之差,得到布朗运动产生的平移扩散系数,然后通过斯托克斯-爱因斯坦方程获得颗粒尺寸。测量粒径时,需注意低浓度颗粒样品因为没有足够的散射光强度进行测量可能无法获得准确的水合粒径分析结果,使用者需要根据样品中的颗粒的实际情况确定最小的测试浓度。另外该法通常适用于直径>3 nm的颗粒。DLS示例见图7。
PTA可以在液体混悬体系中逐个追踪纳米颗粒的布朗运动轨迹,然后应用斯托克斯-爱因斯坦方程来确定粒径。PTA同时可以获得颗粒计数,因此能获得颗粒数量浓度。PTA可用于分析多种组成类型的复杂和多分散样品,其测量粒径的范围通常为10 nm- 2000 nm;颗粒数量浓度的测量范围通常为106-109 个/mL。由于PTA方法的准确性与样品的颗粒大小、浓度、种类、分散性、分散介质黏度等相关,所以对于不同的含纳米材料的样品,其检测上下限会有很大的差异。可通过预试验对样品溶液的系列稀释液进行测量,以评估该样品适合PTA测量的最佳浓度。PTA示例见图8。

5.电感耦合等离子体质谱法(ICP-MS)
ICP-MS是以等离子体为离子源的一种质谱型元素分析方法,适用于痕量到微量重金属元素的分析,其测量过程包括:样品由载气引入雾化系统进行雾化后,以气溶胶形式进入等离子体中心区,在高温和惰性气体中被去溶剂化、汽化解离和电离,转化成带正电荷的正离子,经离子采集系统进入质谱仪,质谱仪根据质荷比进行分离,根据元素质谱峰强度测量样品中相应元素的含量。主要用于多种元素同时测定,特别适用于微量或痕量重金属元素测定。
在应用纳米材料的医疗器械的元素含量分析以及使用过程中的脱落和释放评价中,ICP-MS都是十分重要的分析方法。医疗器械材质种类繁多,需选用适合的酸消解体系对其进行彻底消解,通过内标法等方法谨慎消除复杂基质对分析方法的影响,并利用加标法对系统方法回收率进行评价,以获得准确的定量分析结果。ICP-MS在应用纳米材料的医疗器械中的表征示例见图9。

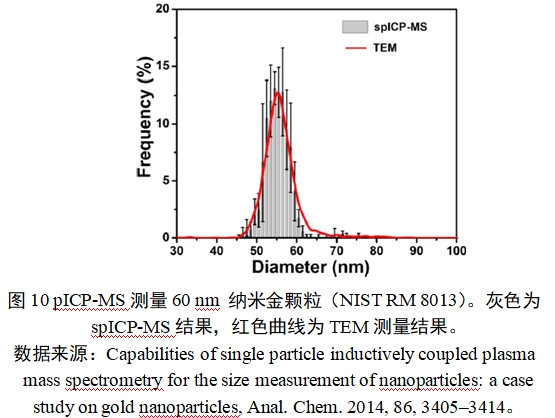
在单颗粒模式中(即单颗粒电感耦合等离子体质谱法,spICP-MS),悬浮颗粒进入ICP离子源时是不连续的,中间会有短暂的时间间隔,因此每个颗粒产生的离子云会在不同时间被检测到。利用颗粒产生离子云的不连续性可分离出单个颗粒的离子云信号,从而实现颗粒计数。单个颗粒含有某元素的质量与其“离子云”中检测到的该元素离子数量成正比,因此可获得颗粒的粒径信息。spICP-MS需要使用标准纳米颗粒材料进行校准,如无法获得标准纳米颗粒材料,也可以使用与待测元素相同的离子标准溶液进行校准。该方法测得的颗粒数量浓度范围为106-109个/L。该方法检测水溶液中的无机纳米颗粒的粒径范围通常为10 nm-100 nm (也可检测到更大的颗粒粒径1000 nm- 2000 nm)。spICP-MS示例见图10。
6.X射线光电子能谱(XPS)法和俄歇电子能谱(AES)法
高能量的电子束(或X射线)激发样品使原子内壳层上的束缚电子发射出来,外层高能量电子跃迁到内层填补空穴并释放能量。一种以光电子形式的辐射,通过检测光电子的能量和强度,可以获得有关材料表面化学成分和结构的信息,该测量方法即为XPS方法。另一种则是将该能量转移给另一个电子,使其从原子中激发出来,形成具有特征能量的俄歇电子,通过检测俄歇电子的能量和强度,也可以获得有关材料表面化学成分和结构的信息,该测量方法即为AES方法。
XPS可检测氦之后所有元素,获得优异的化学位移等化学信息,具有广泛的比对数据库,易分析。但是空间分辨率低(10 μm),且对于结合能位移变化较小的元素价态分析困难较大。
AES可检测所有元素,且化学位移较大,对结合能变化小的特殊元素价态分析更具优势;空间分辨率约为20 nm。但常规元素的化学态及定量分析灵敏性较XPS低,化学位移理论分析较困难,缺乏广泛的信息比对数据库。
XPS和AES示例见图11图12


7.电子能量损失谱(EELS)法
当入射电子束照射试样表面时,将会发生入射电子的背向散射现象,背向散射返回表面的电子由两部分组成,一部分没有发生能量损失,称为弹性散射电子,另一部分有能量损失,称为非弹性散射电子。如果非弹性散射电子的特征能量不但同物质的元素有关,而且同入射电子的能量有关,则称它为特征能量损失电子。如果在试样上检测能量损失电子的数目按能量分布,就可获得一系列谱峰,称为电子能量损失谱,利用这种特征能量电子损失谱进行分析,称为电子能量损失谱(EELS)法。EELS可做包括氢在内的指纹鉴定,也可做表面结构分析。
8.X射线衍射(XRD)法
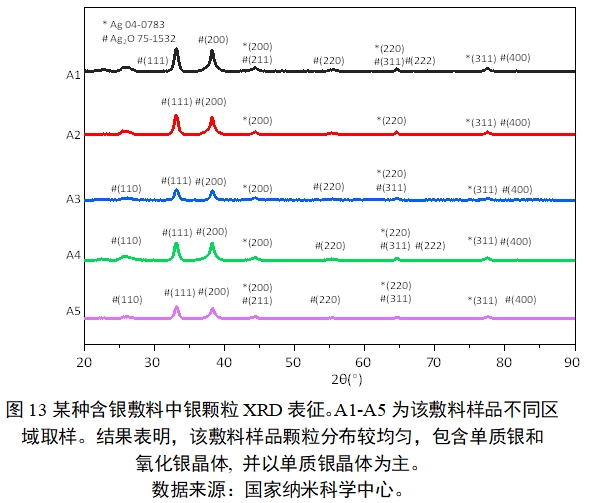
当一束单色X射线入射到晶体时,晶体中周期排布原子(原子上的电子)产生的散射波可相互干涉而叠加,产生衍射现象。即当晶面间距产生的光程差等于波长的整数倍时,满足布拉格方程,晶面的衍射加强。因此,晶体所产生的衍射花样都反映出晶体内部的原子分布规律。XRD示例见图13。
9.气体吸附BET法
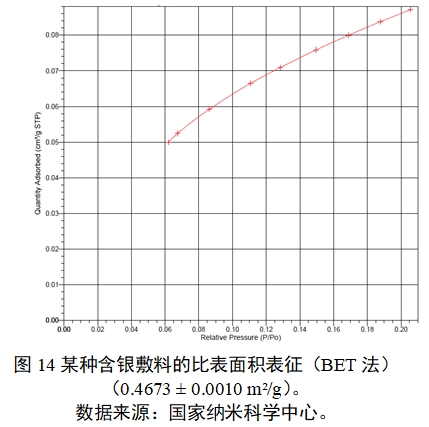
气体吸附法是在朗格缪尔(Langnuir)的单分子层吸附理论的基础上,由Brunauer、Emmett和Teller等三人进行推广,从而得出的多分子层吸附理论(BET理论)方法,因此又称BET法。常用的吸附质为氮气,对于很小的表面积也用氪气。在液氮或液态空气的低温条件下进行吸附,可以避免化学吸附的干扰。BET法只适用于II型(分散、无孔或大孔固体)和IV型(介孔固体,孔径在2 nm-50 nm之间)的吸附等温线。BET法示例见图14。
10.红外吸收光谱法
红外吸收光谱是由分子的振动/转动或晶格振动跃迁引起的红外波段光吸收谱。每种分子都有由其组成和结构决定的特征红外吸收光谱,据此可以对分子进行结构分析和鉴定。红外光谱通常使用傅里叶变换光谱仪测量(即傅里叶变换红外光谱,FTIR)。红外光谱技术测量各种气体、固体、液体样品的吸收、反射光谱等,以及进行定性和定量分析。FTIR示例见图15。

11.拉曼光谱法
拉曼光谱是分子振动光谱的一种,其原理是激发光的光子与材料的晶格振动相互作用产生的非弹性散射光谱,可用来对材料进行指纹分析。拉曼光谱作为一种灵活、无损且高灵敏的光谱表征方法,可广泛用于样品结构和成分表征,并可测量多种类型样品,如固体粉末、液体、纤维、高聚物等,但有色物质或有荧光的物质难以测定。拉曼光谱法示例见图16。

12.紫外可见吸收光谱 (UV-Vis) 法
UV-Vis是利用物质分子对紫外-可见光的吸收光谱,对物质组成结构及含量进行分析测定的常用表征方法。如半导体量子点纳米晶体的带边吸收峰值与其晶体粒径有直接对应关系;带边吸收峰的高度与纳米晶体分散液的浓度有关;峰形与粒径分布有关。通过测量一定尺寸范围内的半导体量子点纳米晶体的UV-Vis吸收光谱,就可以获得该尺寸范围内量子点的粒度及粒度分布(参考国标GB/T 24370)。由于纳米材料的特征吸收峰的位置与其尺寸有关,所以样品制备时需选择合适的方法。如单壁碳纳米管直径小于1.4 nm时,应采用液体分散法制样;直径不小于1.4 nm或直径未知时,应采用固体薄膜分散法制样(参考国标GB/T 39114)。而测量金纳米棒的长径比时,可制备成金纳米棒水溶胶(参考国标GB/T 24369.1)。UV-Vis示例见图17。

13.分子荧光光谱 (MFS) 法
当物质分子吸收了特征频率的光子,就由原来的基态能级跃迁至电子激发态的各个不同振动能级。激发态分子经与周围分子撞击而消耗了部分能量,迅速下降至第一电子激发态的最低振动能级,并停留约10-9秒之后,直接以光的形式释放出多余的能量,下降至电子基态的各个不同振动能级,此时所发射的光即是荧光。根据物质发射的荧光强度与浓度之间的线性关系可以进行物质定量分析;根据荧光光谱的形状与荧光峰对应的波长可以进行物质的定性分析。
14.X射线吸收精细结构谱(XAFS)法
XAFS可提供被探测原子的化学状态和配位环境等有价值的信息,具有高灵敏的化学形态解析能力,可清晰表征生物过程中细胞内银元素的化学形态转化,是建立构效关系和探讨机理研究的重要分析手段。XAFS分为三个部分,边前区(Pre-edge)、近边区(XANES)和扩展边(EXAFS)。XANES可以得到吸收原子的电子结构,包括价态、对称性、轨道占据等信息;EXAFS可以得到吸收原子周围配位信息,包括配位原子种类、键长、配位数、无序度等。示例见图18,利用XAFS发现纳米银由单质转变为银硫键,而后者是诱导细胞毒性的主要形式,导致细胞的氧化应激及线粒体凋亡途径。

附件3
美国食品药品管理局(FDA)纳米技术
实验室介绍及理化表征设备清单
为了支持和促进涉及纳米技术的监管科学研究,并应对FDA所有产品中心的监管挑战,FDA于2011年建立了两个纳米技术核心设施。一个位于马里兰州的FDA总部,另一个位于阿肯色州的Jefferson实验室。
位于阿肯色州的纳米技术核心设施(NanoCore)是由NCTR,FDA监管事务办公室阿肯色实验室(ORA/ARKL)和美国卫生和公众服务部国家毒理学计划(NTP)共同建设的。它支持NCTR和ORA的监管科学研究,并支持其他FDA中心的工作,包括CDER、CFSAN和CDRH。
NanoCore设施在光谱、粒径、表面组成、稳定性分析和表征、元素分析、显微镜、分离/分馏,以及色谱法等方面拥有目前最先进的设备,以满足NCTR和ORA/ARKL研究人员和从事纳米技术分析的研究人员的需要。
位于美国食品和药物管理局马里兰州总部园区的先进表征设施包括许多阿肯色州纳米核心设施中所拥有的同类型最先进仪器,可供常驻和到访的FDA科学家使用。该设施由CDRH科学和工程实验室办公室的研究小组成员运营和管理。先进表征设施的工作重点是开发和改进方法、工具和方法,以改进和加强对医疗产品中人造纳米材料的物理化学表征、安全性和有效性的评估。
纳米技术核心设施,Jefferson实验室,阿肯色州,一个由NCTR、ORA,以及NIEHS/NTP合作以支持监管科学研究的实验室
纳米核心设备:
电子显微镜
• JEOL 2100 透射电子显微镜 (TEM)配EDS探测器(STEM)
• JEOL 1400 TEM配EDS探测器
• 两台Zeiss MERLIN扫描电子显微镜(SEM),第一台配备两个EDAX EDS探测器(30-mm2芯片)以及一个EDAX WDS探测器用于元素分析/elemental analysis/mapping
第二台配备可选的Gatan 3View2XP (原位超显微切片机)以实现软物质的大体积三维重建
• JEOL JSM 6610LV SEM配备EDS探测器
• Delong America 低电压电子显微镜(LVEM25)
原子和光学显微镜
• Asylum Research MFP-3D原子力显微镜(AFM)
• Veeco diCaliber扫描探针显微镜
• Nikon Eclipse Ti-U 倒置显微镜配备落射荧光照明器
• Horiba-Jobin-Yvon Confocal Lab高分辨拉曼显微镜配备拉曼和傅里叶红外探测
• CytoViva Darkfield 超光谱成像系统
• CytoViva Brightfield 超光谱成像系统
光谱仪
• Perkin-Elmer Lambda 45 紫外可见光谱仪
• Perkin-Elmer LS 55 荧光光谱仪
• Perkin-Elmer Spectrum 400 红外光谱仪
• PicoQuant FluoTime 200 高性能荧光寿命光谱仪
• Beacon 2000 变温荧光极化系统
• NS3 用于单壁碳纳米管分析的拉曼、荧光及吸收装置
粒径分析和表征
• Malvern Zetasizer Nano ZS
• Malvern Mastersizer 3000
• Two Nanosight LM-10HS 纳米颗粒径迹分析仪配备红或绿/蓝激光模组
• Sympatec NanoPhox 光子互相关探测器
• Brookhaven ZetaPALS Zeta电势和粒径分析仪
• Izon QNano
• Beckman Coulter 表面积和孔径分析仪SA3100
• Quantachrome Instruments Autosorb iQ2自动气体分析仪
元素分析
• Thermo Scientific X Series 2 电感耦合等离子-质谱仪 (ICP-MS)配备一台New Wave Instruments UP-213 紫外激光消解制样系统
• 两台Agilent 7700-X ICP-MS; 单独使用或与一台高效液相色谱或毛细电泳系统联用
• Agilent QQQ ICP-MS
• Perkin Elmer ICP-MS
• CEM MARS-Xpress 微波加速反应系统 (n=3)
• CEM Discover SP-D 微波消化系统
• Rigaku X射线荧光 (XRF) Primus II Analyzer
• Innov-X 5000 便携式XRF分析仪
• Bruker D2 Phaser X射线衍射系统
分离/分馏设备
• Agilent 7100 毛细电泳系统
• 两台Agilent 1260 制备型二元泵高效液相色谱 (HPLC)系统配备分馏收集器、二极管阵列紫外-可见探测器,以及荧光探测器、折射率探测器、蒸发光散射和带电气溶胶探测器。
• 沃特斯超高效液相色谱法QQQ 质谱仪(UPLC-MS)
• 两台Wyatt Technology Eclipse 3+ 非对称流场分馏 (AFFF)系统配备Dawn Heleos--II 多角度光散射探测器 (以及Optilab T-rEX折射率分析仪)
• GE 快速蛋白质液相色谱系统(FPLC)
• Postnova 离心流场分馏系统配备MALLS和紫外-可见探测器
• CPS 碟式离心系统
附加设备
• CH Instruments 630D 电化学分析仪
• Cambridge VISCOpro 2000 粘度计
• DNA SpeedVac 浓缩器/蒸发器
• Qiagen 组织破损仪 (n=2)
• Thermo Scientific Sorvall WX 超离心
• BioTek Synergy 2 酶标仪
• CEM Discover SP/Explorer 杂交合成系统
• TSI 电喷雾气溶胶发生器/气溶胶采样器
先进表征设施,FDA总部,马里兰州
一个由CDRH、CDER、CBER,以及CFSAN合作以支持监管科学研究的实验室
先进表征设备
• 透射电子显微镜 (TEM)
• 扫描电子显微镜 (SEM)
• 原子力显微镜 (AFM)
• 电感耦合等离子-质谱 (ICP-MS)
• 激光消解系统
• 离子色谱仪
• TEM栅极辉光放电器
• 涡轮泵溅射旋涂机
• TEM栅极柱塞式冷冻机
• 超微切片机
• 微波组织包埋机
• 微波消化系统
• 动态光散射和Zeta分析仪
• Nanosight粒径分析仪
• qNano 可调电阻式脉冲传感粒子分析仪

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
行业资讯
知识分享









 豫公网安备 41010202003160号
豫公网安备 41010202003160号